Des de l'aprovació de Spinraza, un oligonucleòtid antisentit (ASO) per tractar l'atròfia muscular espinal en nens i adults (https://www.fda.gov/news-events/press-announcements/fda-approves-first-d... -muscular-atrophy), els ASO estan emergint com una nova plataforma terapèutica per a les malalties neurodegeneratives.
Tot i això, el seu ús clínic en trastorns cerebrals té encara dues limitacions principals: el lliurament efectiu cap al cervell i el direccionament cap a poblacions cel·lulars específiques.
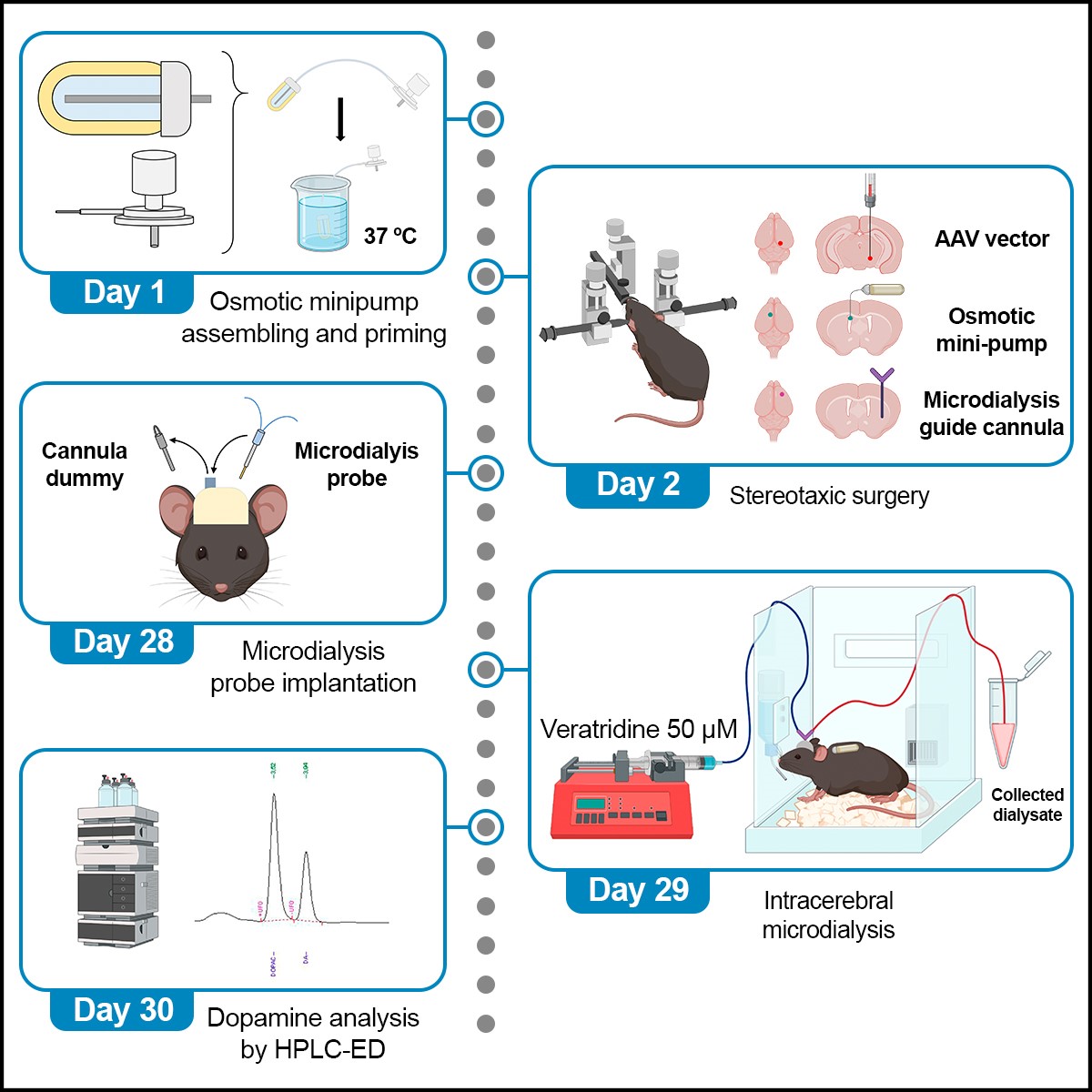
La revista STAR protocols, Cell Press ha publicat un protocol descrit pel grup de Neurofarmacologia de Sistemes del IIBB – CSIC i IDIBAPS que ha estat dirigit per la Dra. Analia Bortolozzi. S'hi detallen els passos optimitzats per generar un model de ratolí que produeix i acumula la proteïna α-sinucleïna humana a les neurones dopaminèrgiques mitjançant un vector viral adeno-associat. Utilitzant aquest model preclínic, vam poder examinar el benefici terapèutic d'un ASO modificat sobre el dèficit del sistema dopaminèrgic induït per α-sinucleïna, semblant al descrit en pacients amb malaltia de Parkinson, tal com explica el Dr. Rubén Pavia Collado, primer signant de l'estudi.
Avenços en el lliurament cel·lular específic d'un ASO dirigit contra α-sinucleïna
Les sinucleines -α-, β-, y - sinucleïna - són una família de proteïnes que s'expressen principalment a les neurones i es concentren a les sinapsis. En concret, la α-sinucleïna està íntimament relacionada amb la neuropatologia de la malaltia de Parkinson. Es creu que formes reactives “tòxiques” de α-sinucleïna són mediadors primerencs dels dèficits funcionals en el sistema dopaminèrgic, conduint a una degeneració posterior d'aquestes neurones. Els models animals similars a la malaltia de Parkinson són necessaris per entendre els mecanismes moleculars i cel·lulars de la malaltia i poden contribuir en el desenvolupament i validació de noves intervencions terapèutiques.
En aquest estudi, es detalla pas-a-pas els procediments per generar un model de ratolí humanitzat que sobreexpressa α-sinucleïna a les neurones dopaminèrgiques utilitzant un vector viral adeno-associat validat per la MJF Foundation. Un dels avantatges d'aquest model és que no requereix el encreuament genètic dels animals per sintetitzar la α-sinucleïna humana. Els ratolins amb sobreexpressió del transgèn van mostrar una acumulació progressiva i agregació de la proteïna α-sinucleïna al sistema dopaminèrgic, provocant alteracions cognitives i motores, que reprodueixen alguns dels símptomes de la malaltia.
El protocol també descriu l'optimització d'una seqüència d'ASO dirigida contra la forma humana de α-sinucleïna expressada a les neurones dopaminèrgiques. Es reporta el procediment per a la implantació conjunta d'una minibomba osmòtica que permet administrar l'ASO directament als ventricles laterals i una cànula de microdiàlisi per a la monitorització de la disponibilitat sinàptica de dopamina. Aquest protocol pot ser utilitzat per avaluar teràpies modificadores de la malaltia de Parkinson i altres sinucleïnopaties basades en oligonucleòtids terapèutics.
Aquest estudi compta amb la participació de Lluis Miquel Rio i Leticia Campa.
Els autors d´aquest estudi pertanyen tots al CIBER de Salut Mental (CIBERSAM, ISCIII).