Desde la aprobación de Spinraza, un oligonucleótido antisentido (ASO) para tratar la atrofia muscular espinal en niños y adultos (https://www.fda.gov/news-events/press-announcements/fda-approves-first-d...), los ASOs están emergiendo como una nueva plataforma terapéutica para las enfermedades neurodegenerativas. Sin embargo, el uso clínico de los mismos para los trastornos cerebrales, tiene aún dos limitaciones principales: la entrega efectiva hacia el cerebro y el direccionamiento hacia poblaciones celulares específicas.
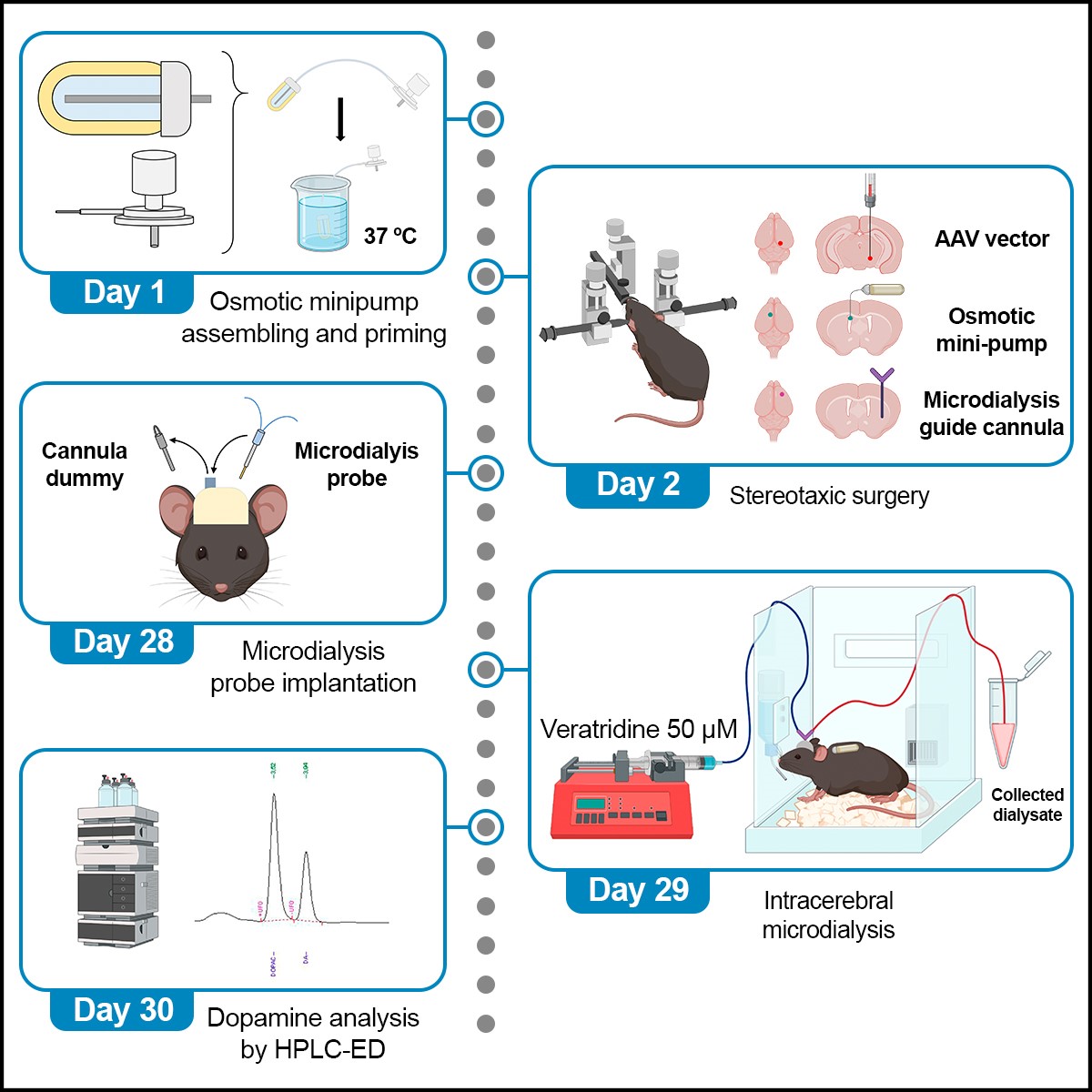
La revista STAR protocols, Cell Press ha publicado un protocolo descrito por el grupo de Neurofarmacología de Sistemas del IIBB – CSIC e IDIBAPS que ha sido dirigido por la Dra. Analia Bortolozzi. En él se detallan los pasos optimizados para generar un modelo de ratón que produce y acumula la proteína α-sinucleína humana en las neuronas dopaminérgicas mediante un vector viral adeno-asociado. Utilizando este modelo preclínico, pudimos examinar el beneficio terapéutico de un ASO modificado sobre el déficit del sistema dopaminérgico inducido por α-sinucleína, similar al descrito en pacientes con enfermedad de Parkinson, tal como explica el Dr. Rubén Pavia Collado, primer firmante del estudio.
Avances en la entrega celular específica de un ASO dirigido contra α-sinucleína
Las sinucleínas -α-, β-, y g-sinucleína- son una familia de proteínas que se expresan principalmente en las neuronas y se concentran en las sinapsis. En concreto, α-sinucleína está íntimamente relacionada con la neuropatología de la enfermedad de Parkinson. Se cree que formas reactivas “tóxicas” de α-sinucleína son mediadores tempranos de los déficits funcionales en el sistema dopaminérgico, conduciendo a una posterior degeneración de estas neuronas. Los modelos animales similares a la enfermedad de Parkinson son necesarios para entender los mecanismos moleculares y celulares de la enfermedad y pueden contribuir con el desarrollo y validación de nuevas intervenciones terapéuticas.
En este estudio, se detalla paso-a-paso los procedimientos para generar un modelo de ratón humanizado que sobre-expresa α-sinucleína en las neuronas dopaminérgicas utilizando un vector viral adeno-asociado validado por la MJF Foundation. Una de las ventajas de este modelo es que no requiere del cruzamiento genético de los animales para sintetizar la α-sinucleína humana. Los ratones con sobreexpresión del transgen mostraron una acumulación progresiva y agregación de la proteína α-sinucleína en el sistema dopaminérgico, provocando alteraciones cognitivas y motoras, que reproducen algunos de los síntomas de la enfermedad.
El protocolo también describe la optimización de una secuencia de ASO dirigida contra la forma humana α-sinucleína expresada en las neuronas dopaminérgicas. Se reporta el procedimiento para la implantación conjunta de una minibomba osmótica que permite administrar el ASO directamente en los ventrículos laterales y una cánula de microdiálisis para la monitorización de la disponibilidad sináptica de dopamina. Este protocolo puede ser utilizado para evaluar terapias modificadoras de la enfermedad de Parkinson y otras sinucleinopatías basadas en oligonucleótidos terapéuticos.
Este estudio cuenta con la participación de Lluis Miquel Rio y Leticia Campa.
Los autores de este estudio pertenecen todos al CIBER de Salud Mental (CIBERSAM, ISCIII)