No obstant, el tractament amb l’antidepressiu d’acció ràpida ketamina reverteix el símptomes depressius actuant directament sobre la via de senyalització del factor eIF2α en aquestes neurones
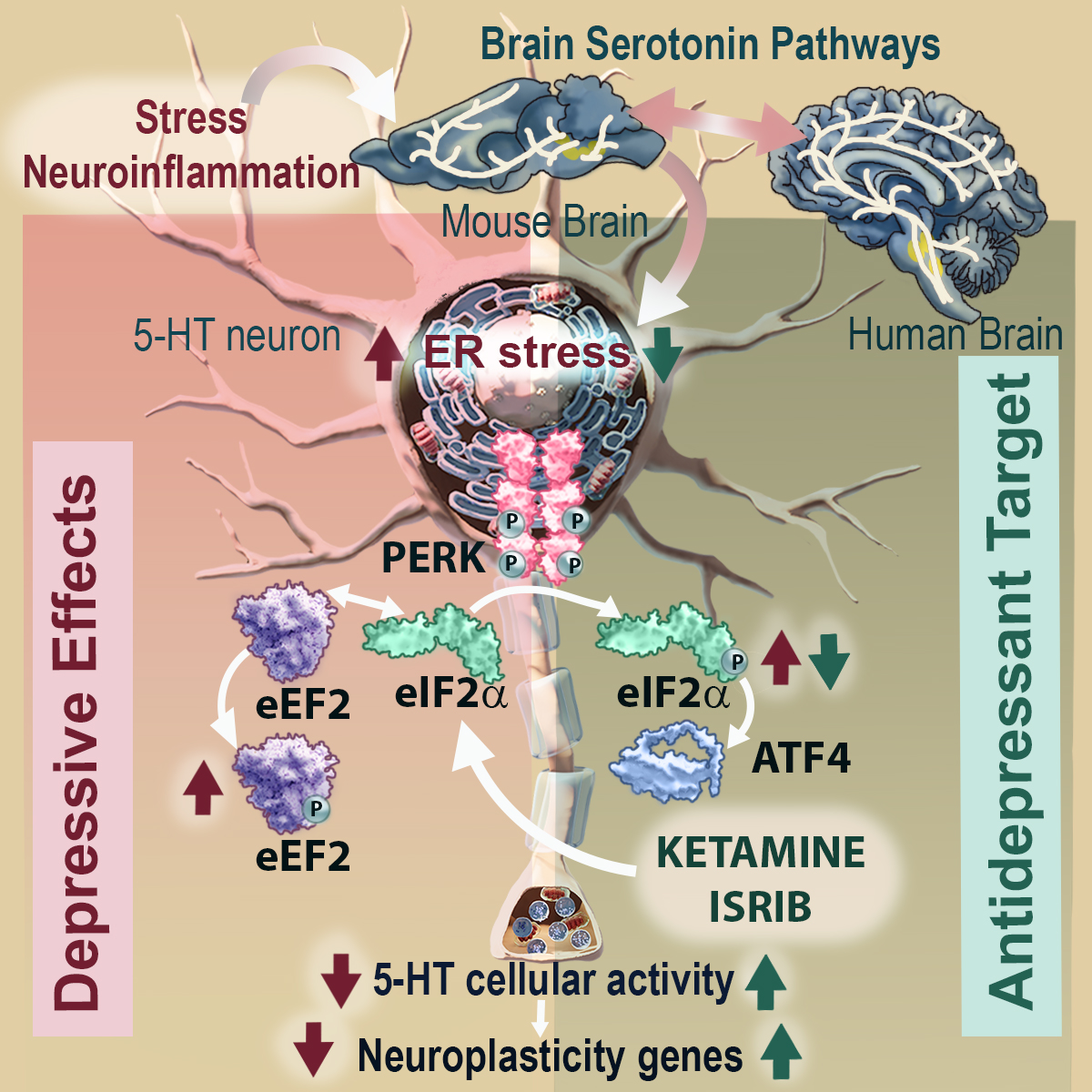
Investigadors del Grup de Neurofarmacologia de Sistemes del IIBB – CSIC han identificat que l’estrès del reticle endoplasmàtic (RE) en les neurones productores de serotonina és una via cel·lular implicada en la fisiopatologia de la depressió i demostren que la regulació del factor eIF2α és fonamental per provocar l’efecte antidepressiu ràpid de la ketamina.
La revista iScience, de Cell Press, publica el treball liderat per la Dra. Analia Bortolozzi, investigadora principal del grup de Neurofarmacologia de Sistemes IDIBAPS, científica del CSIC al IIBB i investigadora del CIBERSAM.
El trastorn depressiu major (TDM) és un repte crític per la salut mental global i la principal causa de discapacitat relacionada amb la salut mental a nivell mundial. El TDM és un trastorn de l’estat d’ànim altament prevalent que afecta de forma negativa a l’àmbit educatiu, social i laboral, i s’associa prospectivament amb l’obesitat, les malalties cardiovasculars i la mort prematura, inclòs el suïcidi.
Aquest trastorn implica un estat d’ànim depressiu, canvis d’energia, trastorns del son, falta de concentració i absència d’interès o excitació. Els estudis de neuroimatge han identificat canvis cerebrals estructurals i funcionals que inclouen reduccions del volum d’estructures corticals i subcorticals, ventricles laterals eixamplats i diferències microestructurals de la substància blanca, que suggereixen un compromís de la integritat de la mielina. Estudis histopatològics han revelat canvis en la densitat de neurones i glia, així com una expressió reduïda de proteïnes sinàptiques. Per tant, totes aquestes troballes convergeixen en que la plasticitat sinàptica és clau en la patogènesi del TDM, tot i que els mecanismes fisiopatològics continuen sent, en gran mesura, desconeguts.
En els últims anys s’ha suggerit que l’estrès cel·lular contribueix a la patogènesi de malalties complexes, com el càncer, la diabetis i els trastorns metabòlics, però també dels trastorns neuropsiquiàtrics i cognitius.
De fet, s’ha plantejat la hipòtesi de que l’estrès cel·lular vinculat a factors d’estrès psicosocial pot ser un dels principals responsables de la progressió del TDM. A l’interior de les cèl·lules eucariotes (animals, humans), el principal orgànul que mostra una resposta adaptativa a l’estrès cel·lular és el reticle endoplasmàtic (RE). En condicions normals, el RE regula múltiples processos biològics amb l’objectiu de mantenir l’homeòstasi proteica i el correcte funcionament cel·lular com, per exemple, la modulació de les sinapsis en les funcions cognitiva i motora. No obstant, davant senyals d’estrès, neuroinflamación o canvis en el calci intracel·lular, entre d’altres, s’indueix una desregulació del RE coneguda com estrès del RE (ERS).
En aquest estudi, ens hem centrat en explorar si la via de senyalització intracel·lular de PERK-eIF2α en les neurones productores de serotonina, en el context d’estrès del RE, contribueixen al fenotip depressiu. Amb aquest objectiu, vam desenvolupar models de ratolí amb estrès del RE en aquestes neurones, que es localitzen a la regió del cervell mitjà. Els nostres resultats mostren que la fosforilació de eIF2α és un mediador clau dels processos de neuroplasticitat dependents de serotonina i recolzen fermament el seu paper com a diana d’acció antidepressiva de la ketamina, afirma la Dra. Bortolozzi.
El Dr. Miquel-Rio, primer firmant de l’article, comenta que a l’induir estrès del RE en aquestes neurones, els ratolins desenvolupen un comportament de tipus depressiu-ansiós en comparació amb els ratolins normals. En paral·lel, els ratolins mostren una reducció de la neurotransmissió serotoninèrgica i de l’expressió de gens de neuroplasticitat en àrees cerebrals com l’escorça prefrontal, l’hipocamp i l’amígdala, directament relacionades amb el control de les emocions. El tractament amb l’antidepressiu ketamina mitiga l’estrès local del RE i reverteix el comportament depressiu-ansiós.
L’estudi també ha demostrat que la via de senyalització de eIF2α té un paper clau en el mecanisme d’acció antidepressiva de la ketamina. En condiciones de bloqueig selectiu de eIF2α-GADD34:PP1, la ketamina no va exercir cap efecte antidepressiu. Bortolozzi comenta que eIF2α pot ser una nova diana d’acció antidepressiva. De fet, l’agent ISRIB, conegut com la molècula miraculosa per al tractament de pràcticament qualsevol afectació neuronal, des de l’Alzheimer fins a lesions cerebrals, i que fins i tot podria ser capaç de rejovenir el cervell i estimular la memòria, bloqueja els efectes de la fosforilació de eIF2α i produeix efectes antidepressius en els models de ratolí utilitzats en l’estudi.
En aquest treball també hi han participat científics de l’Instituto de Biomedicina y Biotecnología de Cantabria (IIBBTEC), del Centro de Investigación Biomédica en Red de Salud Mental (CIBERSAM) i de la Biotecnològica miCure Therapeutics (Tel-Aviv, Israel).
Article de referència
Miquel-Rio L, Sarriés-Serrano U, Sancho-Alonso M, Florensa-Zanuy E, Paz V, Ruiz-Bronchal E, Manashirov S, Campa L, Pilar-Cuéllar F, Bortolozzi A. ER stress in mouse serotonin neurons triggers a depressive phenotype alleviated by ketamine targeting eIF2α signaling. iScience. 2024 Apr 18;27(5):109787. doi: 10.1016/j.isci.2024.109787. PMID: 38711453; PMCID: PMC11070602.