El CHC es el cáncer de hígado más común y la fase final de las enfermedades hepáticas crónicas de diversas etiologías, como la hepatitis viral, la enfermedad hepática alcohólica o la esteatohepatitis no alcohólica (EHNA). Se prevé que el CHC por EHNA aumente en todo el mundo debido a su asociación con la epidemia de obesidad y diabetes de tipo 2.
El sobrepeso y la obesidad son factores de riesgo conocidos para el desarrollo de cáncer, especialmente del CHC. A pesar de las importantes mejoras en el tratamiento del CHC que se han producido en los últimos 20 años, las opciones de tratamiento eficaces se limitan principalmente a los estadios iniciales de la enfermedad. Lamentablemente, el arsenal terapéutico para el CHC es limitado, ineficaz y está sujeto a quimiorresistencia secundaria o adquirida por mecanismos poco conocidos.
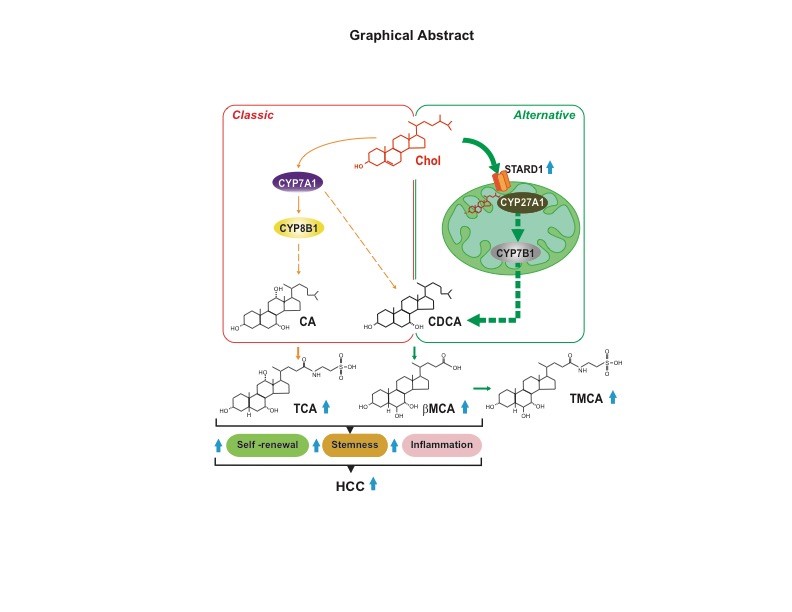
En un reciente estudio publicado en el Journal of Hepatology, con Laura Conde de la Rosa como primera autora, los investigadores coordinados por José C Fernández-Checa líder del grupo "Regulación mitocondrial de la muerte celular" del IIBB-CSIC, en colaboración con Michael Karin (Universidad de California San Diego) descubren un papel crítico de STARD1, una proteína mitocondrial responsable del tráfico de colesterol a la membrana interna de la mitocondria en el CHC provocado por la EHNA a través de la síntesis de ácidos biliares (AsB) en la vía mitocondrial alternativa. Además de su función fisiológica en la formación de la bilis y la digestión de las grasas, los AsB actúan como moléculas de señalización y modulan la tumorigénesis hepática. Utilizando modelos de CHC impulsados por EHNA, la sobreexpresión de STARD1 en ratones WT aumentó la multiplicación de los tumores hepáticos, mientras que la supresión de STARD1 específica de los hepatocitos (Stard1ΔHep) en ratones WT o MUP-uPA redujo la carga tumoral. Estos resultados reflejaron los niveles de AsB primarios no conjugados en los ratones que sobreexpresan STARD1 y Stard1ΔHep. La incubación de las células madre iniciadas por el tumor con una mezcla de AsB que imitan este perfil estimuló la expresión de los genes implicados en la pluripotencia, el estado de célula madre y la inflamación. Por lo tanto, estos hallazgos pueden tener una potencial relevancia clínica y traslacional, ya que identifican a STARD1 como un nuevo actor en el CHC impulsado por la EHNA al regular la generación de AsB a través de la vía alternativa.
Artículo:
https://doi.org/10.1016/j.jhep.2021.01.028
Conde de la Rosa L, Garcia-Ruiz C, Vallejo C, Baulies A, Nuñez S, Monte MJ, Marin JJG, Baila-Rueda L, Cenarro A, Civeira F, Fuster J, Garcia-Valdecasas JC, Ferrer J, Karin M, Ribas V, Fernandez-Checa JC. STARD1 promotes NASH-driven HCC by sustaining the generation of bile acids through the alternative mitochondrial pathway. J Hepatol, in press