Las enfermedades hepáticas colestásicas (EHC) suelen ir acompañadas de daño hepatocelular, fibrosis y cirrosis debido a la acumulación intracelular de solutos que no pueden excretarse en la bilis, incluidos los ácidos biliares (AB), que cuando se acumulan en el hígado inducen insuficiencia hepática por mecanismos poco conocidos. Hay tratamientos terapéuticos disponibles para la EHC, pero son limitados, ya que la respuesta bioquímica al tratamiento de primera línea con ácido ursodesoxicólico se asocia con complicaciones importantes en aproximadamente el 40 % de los pacientes con colangitis biliar primaria (CBP), una forma rara de EHC mediada por el sistema inmunitario.
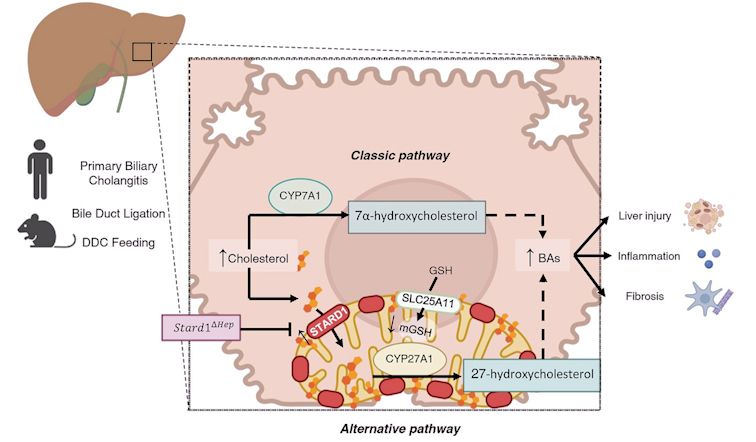
Utilizando muestras de pacientes con CBP y modelos experimentales de colestasis obstructiva completa (modelo de ligadura de la vía biliar, BDL) e inducida químicamente (alimentación con DCC), el trabajo del grupo Regulación Mitocondrial de la Muerte Celular, liderado por Jose C. Fernandez-Checa y Carmen García Ruiz e Investigadores de la Universidad de Salamanca con Laura Conde de la Rosa y Laura Fàbrega como primeros autores, demuestra un papel crucial de STARD1 en la lesión hepatocelular, la inflamación y la fibrosis, que conlleva a su vez la progresión de la EHC. Los pacientes con CBP muestran una mayor expresión de los niveles hepáticos de STARD1, y la eliminación genética de Stard1 en los hepatocitos de ratones protege de la lesión hepática colestásica inducida por la ligadura de la vía biliar (BDL) y la progresión de la enfermedad.
La vía clásica de síntesis de BAs se considera la principal fuente de generación de BAs en el hígado adulto, ya que la expresión de CYP7A1 aumenta después del destete. A diferencia de la vía clásica en la que la expresión de CYP7A1 es el paso regulador, la vía alternativa mitocondrial de síntesis de BAs está controlada por la disponibilidad de colesterol en la membrana interna mitocondrial, que está gobernada por STARD1.
La inducción de STARD1 en la EHC provoca dos eventos importantes, la estimulación de la síntesis de BAs a través de la vía alternativa y el agotamiento de GSH mitocondrial debido a la acumulación de colesterol y la posterior disminución de la fluidez de la membrana, que sensibiliza a los hepatocitos primarios a la citotoxicidad y la respuesta inflamatoria inducidas por BAs. Los hallazgos in vivo en BDL se reprodujeron in vitro en hepatocitos primarios de ratón cultivados con agotamiento farmacológico de GSH mitocondrial, lo que desenmascaró su sensibilidad a la citotoxicidad e inflamación inducidas por BA, así como el daño del ADN revelado por la longitud de la cola del cometa. Por lo tanto, nuestros hallazgos identifican un papel previamente no reconocido para STARD1 en la colestasis y sugieren que dirigirse a STARD1 puede ser un enfoque novedoso para la EHC.
Referencia del artículo:
Conde de la Rosa L, Fábrega L, Torres S, Nuñez S, Ribas V, Segalés P, Espinosa-Escudero R, Solsona E, Monte MJ, Diaz-Gonzalez A, Marin JJG, García-Ruiz C, Fernandez-Checa JC. Stard1 promotes cholestatic liver injury and disease progression by sensitizing to bile acid hepatotoxicity. HEPATOLOGY 2024 Dec 9. doi: 10.1097/HEP.0000000000001184.